TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKIN
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKIN nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 13-01-2018
59,887 lượt xem
III. Tính chất hoá học
* Nhận xét: Ankin có 2 liên kết π bền hơn anken nên ngoài việc tham gia phản ứng cộng và oxi hóa (thể hiện tính chất của hidrocacbon không no) thì ankin còn có khả năng tham gia phản ứng thế với ion kim loại (tính chất đặc trưng của ankin có liên kết 3 đầu mạch).
1. Phản ứng cộng hợp
- Giai đoạn 1: Liên kết ba → Liên kết đôi
- Giai đoạn 2: Liên kết đôi → Liên kết đơn
a. Cộng hợp H2: (điều kiện phản ứng Ni, t0) → ankan
Ví dụ:
CH ≡ CH + H2 CH2 – CH3
CH ≡ CH + H2 CH2 = CH2
Tổng quát: CnH2n-2 + 2H2 → CnH2n+2
- Nếu điều kiện phản ứng Pd/PbCO3, t0 phản ứng dừng lại ở giai đoạn 1.
CnH2n-2 + H2 → CnH2n
* Lưu ý:
- Tuỳ thuộc vào xúc tác được sử dụng mà phản ứng cộng H2 vào ankin xảy ra theo các hướng khác nhau.
- Thường thì phản ứng cộng H2 vào ankin thường tạo ra hỗn hợp gồm nhiều sản phẩm.
- Số mol khí giảm = số mol H2 tham gia phản ứng.
b. Cộng brom
CnH2n-2 + Br2 → CnH2n-2Br2
CnH2n-2 + 2Br2 → CnH2n-2Br4
* Lưu ý:
- Khối lượng dung dịch brom tăng chính là khối lượng ankin đã phản ứng.
c. Cộng hợp hiđrohalogenua
CH≡CH + HCl → CH2=CHCl (vinyl clorua) (Hg2Cl2 ở 150 đến 2000C)
CH≡CH + HCN → CH2=CH-CN (nitrin acrylic)
CH≡CH + CH3COOH → CH3COOCH=CH2 (vinylaxetat)
CH≡CH + C2H5OH → CH2=CH-O-CH3 (etylvinylete)
d. Cộng H2O
- C2H2 → anđehit
CH≡CH + H2O → CH3 - CHO (H2SO4, HgSO4, 800C)
- Ankin khác → xeton
CH≡C-CH3 + H2O → CH3-CO-CH3 (H+)
2. Phản ứng trùng hợp
- Đime hóa (điều kiện phản ứng: NH4Cl, Cu2Cl2, t0)
2CH≡CH → CH≡C-CH=CH2 (vinyl axetilen)
- Trime hóa (điều kiện phản ứng: C, 6000C)
3CH≡CH → C6H6 (benzen)
- Trùng hợp (polime hóa) (điều kiện phản ứng: xt, t0, p)
nCH≡CH → (-CH=CH-)n (nhựa cupren)
3. Phản ứng oxi hóa
a. Phản ứng oxi hóa hoàn toàn
CnH2n-2 + (3n - 1)/2O2 → nCO2 + (n - 1)H2O
→ đặc điểm của phản ứng đốt cháy ankin: nCO2 > nH2O và nCO2 - nH2O = nankin.
b. Phản ứng oxi hóa không hoàn toàn
- Các ankin đều làm mất màu dung dịch thuốc tím ở nhiệt độ thường.
3C2H2 + 8KMnO4 + 2H2O → 3(COOK)2 + 2MnO2 + 2KOH
Nếu trong môi trường axit thì tạo thành CO2 sau đó CO2 phản ứng với KOH tạo thành muối.
- Với các ankin khác sẽ có sự đứt mạch tạo thành hỗn hợp 2 muối.
R1-C≡C-R2 + 2KMnO4 → R1COOK + R2COOK + 2MnO2
4. Phản ứng thế của ank-1-in
- Thí nghiệm: Sục khí axetilen vào dung dịch hỗn hợp AgNO3/NH3 có hiện tượng kết tủa màu vàng.
CH ≡ CH + 2 AgNO3 + 2 NH3–> CAg ≡ CAg + 2 NH4NO3
* Lưu ý:
- Chỉ có C2H2 mới phản ứng với AgNO3 theo tỉ lệ mol 1:2; các ank-1-in khác chỉ phản ứng theo tỉ lệ 1:1.
- Nếu có hỗn hợp ankin tham gia phản ứng với AgNO3 mà tỉ lệ mol của (ankin : AgNO3) = k có giá trị:
+ k > 1 → có C2H2.
+ k = 1 → ank-1-in
+ k = 1 → hỗn hợp gồm 2 ank-1-in hoặc hỗn hợp C2H2 và ankin khác (không phải ank-1-in) có số mol bằng nhau.
- Từ kết tủa vàng thu được có thể khôi phục lại ankin ban đầu bằng cách cho tác dụng với HCl.
CAg≡C-R + HCl → CH≡C-R + AgCl
(phản ứng này dùng để tách ank-1-in khỏi hỗn hợp)
- Dung dịch AgNO3/NH3 và phản ứng này được dùng để nhận biết ank-1-in.
IV. Điều chế
- Nhiệt phân metan: (15000C, làm lạnh nhanh)
2CH4 → C2H2 + 3H2
- Thủy phân CaC2: (có trong đất đèn)
CaC2 + 2H2O → Ca(OH)2 + C2H2
- Axetilen cháy trong oxi tạo ra ngọn lửa có nhiệt độ khoảng 30000C nên được dùng trong đèn xì axetilen - oxi để hàn và cắt kim loại:
C2H2 + O2 → 2CO2 + H2O
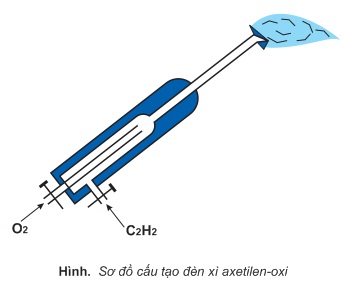
Sử dụng axetilen phải rất cẩn trọng vì khi nồng độ axetilen trong không khí từ trở lên có thể gây cháy nổ.
- Axetilen và các ankin khác còn được dùng làm nguyên liệu để tổng hợp các hóa chất cơ bản khác như vinyl clorua, vinyl axetat, vinylaxetilen, anđehit axetic,..
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA ANKEN VÀ ANKIN
- › SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA ANKAN VÀ ANKEN
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANCOL
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TINH CHẤT VẬT LÍ CỦA ANCOL
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA STIREN
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TÍNH CHẤT VẬT LÍ CỦA ANKIN
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKADIEN
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TÍNH CHẤT VẬT LÍ CỦA ANKADIEN
- › PHẢN ỨNG CỘNG HX VÀO HIDROCACBON KHÔNG NO
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKEN










Gửi bình luận của bạn