PHÂN TÍCH ĐỊNH TÍNH VÀ PHÂN TÍCH ĐỊNH LƯỢNG HỢP CHẤT HỮU CƠ
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần PHÂN TÍCH ĐỊNH TÍNH VÀ PHÂN TÍCH ĐỊNH LƯỢNG HỢP CHẤT HỮU CƠ nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 08-12-2017
57,258 lượt xem
A. NGUYÊN TẮC CHUNG
Phân tích nguyên tố là để xác định thành phần và khối lượng các nguyên tố có trong hợp chất hữu cơ.
Chuyển hóa hợp chất hữu cơ thành các chất vô cơ đơn giản (CO2, SO2, H2O, NH3, HCl,...) hoặc ion. Sau đó sử dụng phương pháp phân tích vô cơ đã biết để xác định chúng.
B. PHƯƠNG PHÁP PHÂN TÍCH NGUYÊN TỐ
I. Phân tích định tính
- Phân tích định tính nguyên tố nhằm xác định các nguyên tố có mặt trong hợp chất hữu cơ bằng cách phân hủy hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
1. Xác định C và H
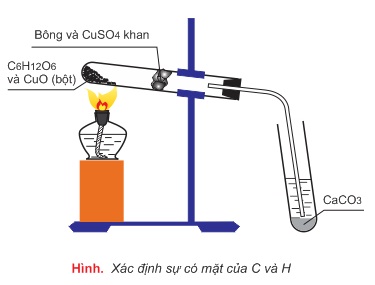
Ví dụ:
không màu màu xanh
CxHyOzNt + H2SO4 → (NH4)2SO4 +...
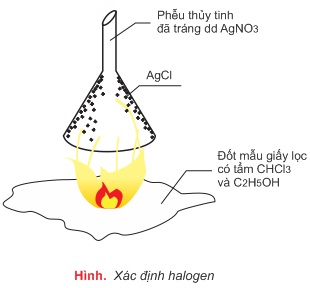
3. Xác định halogen
- Khi đốt, hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng và được nhận biết bằng bạc nitrat:
Hướng dẫn giải
H2SO4 đặc hút nước → khối lượng bình 1 tăng lên là khối lượng H2O
mH2O = 14,4g
→ nH2O = 14.4/18 = 0,8 mol
→ mH = 0,8.2 =1,6 g → %H = 1,6.100/12 = 13,33%
Nước vôi trong hấp thụ CO2 → khối lượng kết tủa là CaCO3 = 60g
nCO2 = nCaCO3 = 60/100 = 0,6 mol
→ mC = 0,6.12 = 7,2g → %C = 7,2.100/12 = 60%
→ %O = 100 - (60 + 13,33) = 26,67%
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › PHẢN ỨNG CỘNG HX VÀO HIDROCACBON KHÔNG NO
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKEN
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TINH CHẤT VẬT LÍ CỦA ANKEN
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKAN
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TÍNH CHẤT VẬT LÍ CỦA ANKAN
- › CÔNG THỨC HỢP CHẤT HỮU CƠ VÀ THIẾT LẬP CÔNG THỨC PHÂN TỬ
- › CÁCH GỌI TÊN THÔNG THƯỜNG, TÊN GỐC CHỨC VÀ TÊN THAY THẾ HỢP CHẤT HỮU CƠ
- › ĐỒNG ĐẲNG, ĐỒNG PHÂN HỢP CHẤT HỮU CƠ
- › KHÁI NIỆM, PHÂN LOẠI, ĐẶC ĐIỂM VÀ CÁC PHƯƠNG PHÁP TINH CHẾ HỢP CHẤT HỮU CƠ
- › ĐỒ GỐM, THỦY TINH, VÀ XI MĂNG CỦA NGÀNH CÔNG NGHỆ SILICAT










Gửi bình luận của bạn