CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AMONIAC
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AMONIAC nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 28-09-2017
12,948 lượt xem

1. Cấu tạo và tính chất vật lí
a. Cấu tạo
- Công thức phân tử: NH3.
- Cấu trúc phân tử:
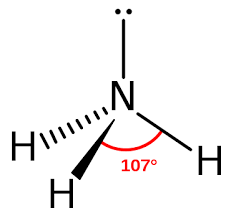
b. Tính chất vật lí
- Là chất khí không màu, mùi khai và xốc. Tan nhiều trong nước.
2. Tính chất hóa học
a. Tính bazơ yếu
Nhận xét: N trong NH3 còn 1 cặp electron chưa tham gia liên kết nên nhận proton → có tính bazơ yếu.
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
- Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
→ Dung dịch NH3 làm cho quỳ tím chuyển màu xanh, phenolphtalein không màu chuyển màu hồng.
- Tác dụng với axit → muối amoni
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
- Tác dụng với dung dịch muối của các kim loại mà hiđroxit không tan → bazơ và muối:
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)3](OH)2
xanh thẫm
b. Tính khử mạnh
- Số oxi hóa của nitơ: -3 0 +1 +2 +3 +4 +5
- Nhận xét: N trong NH3 có mức oxi hóa thấp nhất nên NH3 có tính khử mạnh.
- Tác dụng với O2
4NH3 + 3O2 → 2N2 + 6H2O (t0 thường)
4NH3 + 5O2 → 4NO + 6H2O (8500C và có Pt làm xúc tác)
- Tác dụng với Cl2
2NH3 + 3Cl2 → N2 + 6HCl (t0)
8NH3 + 3Cl2 → N2 + 6NH4Cl
- Tác dụng với oxit của kim loại
3CuO + 2NH3 → N2 + 3H2O + N2 (t0)
* Kết luận
- NH3 có tính bazơ khi phản ứng H2O, axit và dung dịch muối của bazơ không tan.
- NH3 thể hiện tính khử mạnh khi tác dụng với các chất oxi hóa.
3. Điều chế
a. Trong phòng thí nghiệm
- Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
- Nhiệt phân muối amoni
NH4Cl → NH3 + HCl (t0)
NH4HCO3 → NH3 + H2O + CO2 (t0)
b. Trong công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
4. Nhận biết amoniac
- Khí không màu có mùi khai.
- Khí làm cho quỳ tím chuyển màu xanh hoặc làm cho phenolphtalein không màu chuyển màu hồng.
- Tạo khói trắng với HCl đặc.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHOTPHO
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ỨNG DỤNG CỦA MUỐI NITRAT
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT NITRIC
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ĐIỀU CHẾ MUỐI AMONI
- › CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA NITƠ
- › KIẾN THỨC CẦN NẮM VỮNG VỀ SỰ ĐIỆN LI
- › PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CHẤT ĐIỆN LI
- › PHẢN ỨNG AXIT BAZƠ VÀ THỨ TỰ PHẢN ỨNG AXIT BAZƠ
- › LÍ THUYẾT VỀ PH VÀ MÔI TRƯỜNG DUNG DỊCH










Gửi bình luận của bạn