CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHOTPHO
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHOTPHO nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 17-10-2017
68,531 lượt xem
I. Trạng thái tự nhiên và tính chất vật lí
1. Trạng thái tự nhiên
- Trong tự nhiên chỉ tồn tại ở dạng hợp chất. Hai khoáng vật chính là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2.

Quặng Apatit - ở Lào Cai
2. Tính chất vật lí
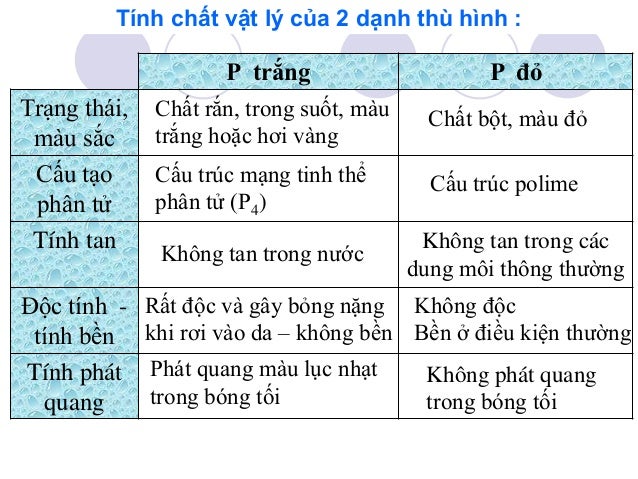
Thường gặp 2 dạng thù hình phổ biến là P đỏ và P trắng:

a. Photpho trắng
- Là chất rắn trong suốt, màu trắng hoặc vàng nhạt, giống sáp, có cấu trúc mạng tinh thể phân tử : ở các nút mạng là các phân tử hình tứ diện P4 liên kết với nhau bằng lực tương tác yếu. Do đó photpho trắng mềm dễ nóng chảy (t0nc = 44,10C)
- Photpho trắng không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ như benzen, cacbon đisunfua, ete, …; rất độc gây bỏng nặng khi rơi vào da.
- Photpho trắng bốc cháy trong không khí ở t0 > 400C, nên được bảo quản bằng cách ngâm trong nước.
- Ở nhiệt độ thường, photpho trắng phát quang màu lục nhạt trong bóng tối. Khi đun nóng đến 2500C không có không khí, photpho trắng chuyển dần thành photpho đỏ là dạng bền hơn.
b. Photpho đỏ
- Là chất bột màu đỏ có cấu trúc polime nên khó nóng chảy và khó bay hơi hơn photpho trắng
- Photpho đỏ không tan trong các dung môi thông thường, dễ hút ẩm và chảy rữa.
- Photpho đỏ bền trong không khí ở nhiệt độ thường và không phát quang trong bóng tối. Nó chỉ bốc cháy ở t0 > 2500C.
c. Chuyển hóa qua lại giữa P trắng và P đỏ
- Khi đun nóng không có không khí, photpho đỏ chuyển thành hơi, khi làm lạnh thì hơi của nó ngưng tụ lại thành photpho trắng.
* Lưu ý:
- Trong phòng thí nghiệm, người ta thường sử dụng photpho đỏ.
II. Tính chất hóa học
- Các mức oxi hóa có thể có của P: -3, 0, +3, +5.
- P hoạt động hóa học mạnh hơn N2 vì liên kết P - P kém bền hơn so với liên kết N ≡ N.
- P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử còn P đỏ có cấu trúc kiểu polime).
1. Tính oxi hóa
- P có phản ứng với nhiều kim loại → muối photphua:
2P + 3Zn → Zn3P2
* Lưu ý: Các muối photphua bị thủy phân mạnh giải phóng photphin (PH3).
Ca3P2 + 6H2O → 2PH3 + 3Ca(OH)2
- Photphin là một khí không màu rất độc, có mùi tỏi, bốc cháy trong không khí ở nhiệt độ gần 1500C.
2PH3 + 4O2 → P2O5 + 3H2O
2. Tính khử (đặc trưng của photpho)
- Phản ứng với O2
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5 (nếu O2 dư)
(P trắng phản ứng được ở ngay nhiệt độ thường và có hiện tượng phát quang hóa học; P đỏ chỉ phản ứng khi nhiệt độ > 2500C).
- Phản ứng với halogen
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
- Phản ứng với các chất oxi hóa khác
6Pđ + 3KClO3 → 3P2O5 + 5KCl (t0) (phản ứng xảy ra khi quẹt diêm)
6Pt + 5K2Cr2O7 → 5K2O + 5Cr2O3 + 3P2O5
P + 5HNO3 → H3PO4 + 5NO2 + H2O
2P + 5H2SO4 đặc → 2H3PO4 + 3H2O + 5SO2
III. Điều chế
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO (lò điện ở 15000C)
IV. Ứng dụng
Phốtpho có rất nhiều ứng dụng trong công nghiệp, đời sống và kể cả trong quân sự.
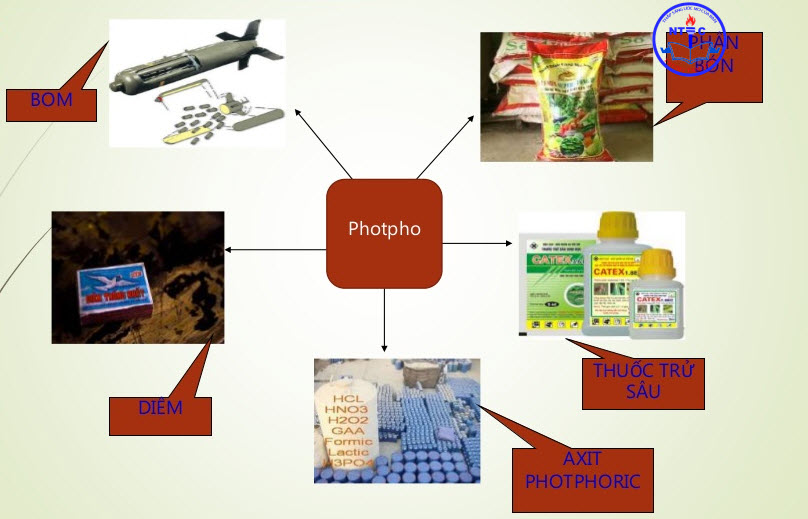
- Phốtpho trắng có ứng dụng trong quân sự là phần lớn bởi tính dễ cháy, tạo màn khói, sương độc. Phốtpho trắng cháy ngay ở nhiệt độ thường khi tiếp xúc với Oxi và tạo ra ngọn lửa rất độc với con người.
- Phốtpho đỏ không cháy ở nhiệt độ thường và thường được sử dụng làm hóa chất trong công nghiệp và trồng trọt.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON DIOXIT (CO2)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON MONO OXIT (CO)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON
- › PHÂN BÓN HÓA HỌC, PHÂN LOẠI, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA TỪNG LOẠI PHÂN HÓA HỌC
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ỨNG DỤNG CỦA MUỐI NITRAT
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT NITRIC
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ĐIỀU CHẾ MUỐI AMONI
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AMONIAC
- › CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA NITƠ










Gửi bình luận của bạn