CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 17-10-2017
19,528 lượt xem

A. AXXIT PHOPHORIC
I. Cấu tạo phân tử
- Công thức phân tử : H3PO4
- Công thức cấu tạo:
- Nhận xét: P có số oxi hóa + 5 và có hóa trị V.
II. Tính chất vật lí
- Tồn tại ở dạng lỏng siro, không màu, không mùi, dễ tan trong nước và rượu, không độc.
III. Tính chất hóa học
1. Là axit trung bình
- Trong dung dịch H3PO4 phân li thuận nghịch theo 3 nấc:
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
* Lưu ý: Trong dung dịch H3PO4 chứa đồng thời các ion H+, H2PO4-, HPO42-, PO43- và H3PO4
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ → muối + H2O
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
- Tác dụng với bazơ → muối + H2O .
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
* Lưu ý: Tùy theo tỉ lệ phản ứng có thể tạo thành các muối khác nhau:
Gọi nOH-/ n H3PO4 = T thì
+ T < hoặc = 1 → muối H2PO4-
+ T = 2 → HPO42-
+ 1 < T <2 → 2 muối: H2PO4- và HPO42-
+ 2 < T <3 → 2 muối: HPO42- và PO43-
+ T > hoặc = 3 → PO43-
- Tác dụng với kim loại đứng trước H2 → muối + H2
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
- Tác dụng với muối → muối mới + axit mới
H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
2. Tính oxi hóa - khử
Trong H3PO4, P có mức oxi hóa +5 là mức oxi hóa cao nhất nhưng H3PO4 không có tính oxi hóa như HNO3 vì nguyên tử P có bán kính lớn hơn so với bán kính của N → mật độ điện dương trên P nhỏ → khả năng nhận e kém.
3. Các phản ứng do tác dụng của nhiệt
2H3PO4 → H4P2O7 + H2O (200 – 2500C)
Axit điphotphoric
H4P2O7 → 2HPO3 + H2O (400 – 5000C)
Axit metaphotphoric
* Lưu ý: Axit photphorơ H3PO3 là axit 2 lần axit.
IV. Điều chế
1. Trong phòng thí nghiệm
P + 5HNO3 đặc → H3PO4 + 5NO2 + H2O (t0)
2. Trong công nghiệp:
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (t0)
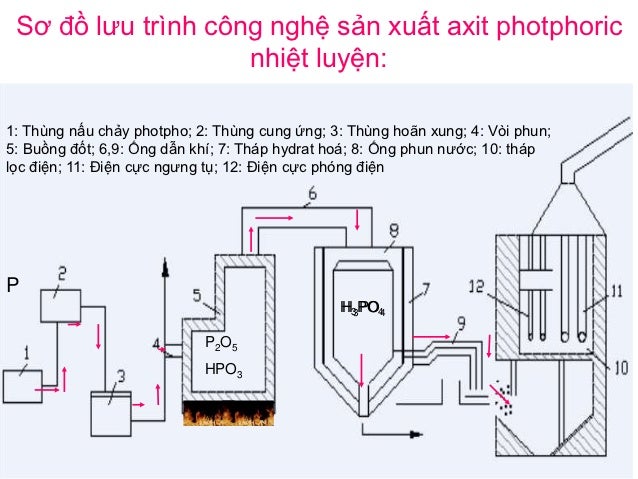
* Lưu ý: Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
B. MUỐI PHOTPHAT
I. Khái niệm
- Muối phophat là muối của axit phophoric
- Có 3 loại: muối photphat (PO43-), muối hidrophotphat (HPO42- ) và muối đihidrophophat (H2PO4-).
II. Tính chất vật lí
- Tất cả muối H2PO4- đều tan; muối PO43- và HPO42- chỉ có muối của kim loại kiềm và amoni tan được.
III. Tính chất hóa học
- Muối photphat có đầy đủ các tính chất hóa học của muối.
- Các muối photphat của kim loại kiềm dễ bị thủy phân trong dung dịch tạo môi trường bazơ:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O → HPO42- + OH-
- Muối axit còn biểu hiện tính chất của axit.
NaH2PO4 + NaOH → Na2HPO4 + H2O
IV. Điều chế
- Cho P2O5 hoặc H3PO4 tác dụng với dung dịch kiềm.
- Dùng phản ứng trao đổi ion.
IV. Nhận biết ion photphat
- Tạo kết tủa vàng với dung dịch AgNO3.
3Ag+ + PO43- → Ag3PO4
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ NHẬN BIẾT MUỐI CACBONAT
- › CẤU TẠO TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON DIOXIT (CO2)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON MONO OXIT (CO)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON
- › PHÂN BÓN HÓA HỌC, PHÂN LOẠI, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA TỪNG LOẠI PHÂN HÓA HỌC
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHOTPHO
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ỨNG DỤNG CỦA MUỐI NITRAT
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT NITRIC
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ĐIỀU CHẾ MUỐI AMONI
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AMONIAC










Gửi bình luận của bạn