CẤU TẠO TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON DIOXIT (CO2)
Trung tâm gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu CẤU TẠO TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON DIOXIT (CO2) nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 10-11-2017
13,687 lượt xem

1. Cấu tạo phân tử và
- Công thức phân tử: CO2
- Công thức cấu tạo: O=C=O.
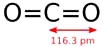
2. Tính chất vật lí
- Là khí không màu, vị hơi chua. Tan ít trong nước. CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
3. Tính chất hóa học
a. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu) CO2 + H2O ↔ H2CO3
- CO2 tác dụng với oxit bazơ → muối.
CaO + CO2 → CaCO3 (t0)
- CO2 tác dụng với dung dịch bazơ → muối + H2O
Ví dụ 1:
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Ví dụ 2:
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + H2O + CO2 → Ca(HCO3)2
* Lưu ý: Tùy theo tỉ lệ phản ứng có thể tạo thành các muối khác nhau:
Gọi nOH-/ n CO2 = T thì
+ T < hoặc = 1 → muối HCO3-
+ T > hoặc = 2 → CO32-
+ 1 < T <2 → 2 muối: HCO3- và CO32-
b. CO2 bền, ở nhiệt độ cao thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
* Lưu ý: Được dùng để giải thích CO2 không dùng để dập tắt các đám cháy kim loại.
4. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (10000C)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
5. Ứng dụng
- Băng khô CO2 được sử dụng trong làm lạnh thực phẩm, làm sạch bề mặt thay cho cát, gây mưa nhân tạo.
- Khí CO2 được sử dụng nhiều trong ngành sản xuất nước giải khát có ga và bia rượu.
- Trong công nghệ hàn CO2 được sử dụng làm khí bảo vệ trong một số phương pháp hàn.
- CO2 được dùng để sản xuất ure
CO2 + 2NH3 → H2O + (NH2)2CO (1800C; 200at)
* Lưu ý: Khí CO2 không độc, không gây cháy nổ, tuy nhiên khi nồng độ quá cao sẽ gây nguy hại đến sức khỏe con người vì nó nặng hơn không khí nên có thể tích tụ tại các nơi kín khí như ở các giếng khô, hang động,...
6. Nhận biết
Tạo kết tủa trắng với dung dịch nước vôi trong dư.
CO2 + Ca(OH)2 → CaCO3 + H2O
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › ĐỒ GỐM, THỦY TINH, VÀ XI MĂNG CỦA NGÀNH CÔNG NGHỆ SILICAT
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC VÀ ỨNG DỤNG CỦA AXIT SILIXIC (H2SiO3) VÀ MUỐI SILICAT
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC VÀ ỨNG DỤNG CỦA SILIC DIOXIT (SiO2)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA SILIC
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ NHẬN BIẾT MUỐI CACBONAT
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON MONO OXIT (CO)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CACBON
- › PHÂN BÓN HÓA HỌC, PHÂN LOẠI, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA TỪNG LOẠI PHÂN HÓA HỌC
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT
- › CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHOTPHO










Gửi bình luận của bạn