LÍ THUYẾT VỀ PH VÀ MÔI TRƯỜNG DUNG DỊCH
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu LÍ THUYẾT VỀ PH VÀ MÔI TRƯỜNG DUNG DỊCH nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 02-09-2017
46,412 lượt xem

1. Sự điện li của nước
- Nước là chất điện li rất yếu (ở nhiệt độ thường, cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li thành ion).
H2O ⇌ H+ + OH-
- Tích số: KH2O = [H+].[OH-] = 1,0.10-14 được gọi là tích số ion của nước. Giá trị này được tính với nước ở 250c.
Một cách gần đúng, có thể coi giá trị tích số ion của nước là hằng số cả trong dung dịch loãng của các chất khác nhau.
* Ý nghĩa:
- Nước có môi trường trung tính, nên có thể xem: Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 1,0.10-7.
- Khi hòa tan axit vào nước, nồng độ [H+] tăng, nên nồng độ [OH-] phải giảm sao cho tích số ion của nước không đổi.
Môi trường axit: [H+] > 1,0.10-7.
- Khi hòa tan bazo vào nước, nồng độ [OH-] tăng, nên nồng độ [H+] phải giảm sao cho tích số ion của nước không đổi.
Môi trường bazo: [H+] < 1,0.10-7.
2. Khái niệm về pH
- Nếu dung dịch có [H+] = 1,0.10-a → pH = a.
- Biểu thức toán học tính pH: pH = -lg[H+].
- Tương tự có khái niệm pOH, pK. Ta có mối quan hệ trong dung dịch nước: pH + pOH = 14.
* Ý Nghĩa:
- Thang pH thường dùng có giá trị 1 đến 14.
- Giá trị có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi. Thực vật có thể sinh trưởng bình thường chỉ khi giá trị pH của dung dịch trong đất ở trong khoảng xác định đặc trưng cho mỗi loại cây. Tốc độ ăn mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào pH của nước mà kim loại tiếp xúc.
3. Các loại môi trường
|
Môi trường |
[H+] |
pH |
Là dung dịch của |
|
Axit |
> 10-7 |
< 7 |
Axit hoặc chất lưỡng tính mà tính axit mạnh hơn tính bazơ |
|
Bazơ |
< 10-7 |
> 7 |
Bazơ hoặc chất lưỡng tính mà tính bazơ mạnh hơn tính axit |
|
Trung tính |
= 10-7 |
= 7 |
Chất trung tính hoặc chất lưỡng tính mà tính axit và bazơ tương đương |
4. Chất chỉ thị axit - bazơ
- Chất chỉ thị axit - bazơ là chất có màu biến đổi phụ thuộc vào giá trị của dung dịch.
Thí dụ, màu của hai chất chỉ thị axit bazơ là quỳ và phenolphtalein trong các khoảng khác nhau được đưa ra trong bảng .
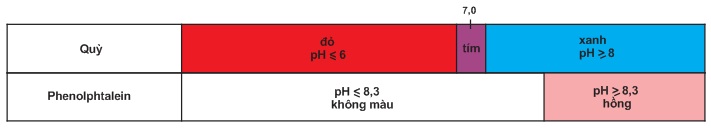
Bảng . Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị , ta được hỗn hợp chất chỉ thị vạn năng. Dùng băng giấy tẩm dung dịch hỗn hợp này có thể xác định được gần đúng giá trị của dung dịch

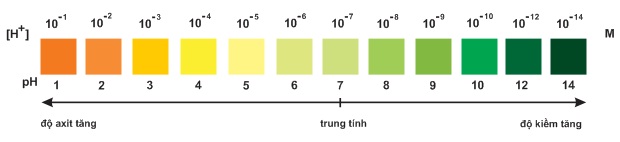
Hình Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị khác nhau.

Máy đo pH
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › KHÁI NIỆM, TÍNH CHẤT HÓA HỌC VÀ ĐIỀU CHẾ MUỐI AMONI
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AMONIAC
- › CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA NITƠ
- › KIẾN THỨC CẦN NẮM VỮNG VỀ SỰ ĐIỆN LI
- › PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CHẤT ĐIỆN LI
- › PHẢN ỨNG AXIT BAZƠ VÀ THỨ TỰ PHẢN ỨNG AXIT BAZƠ
- › CÁCH SO SÁNH LỰC MẠNH BAZƠ GIỮA CÁC BAZƠ VỚI NHAU
- › LÍ THUYẾT AXIT, BAZƠ VÀ MUỐI
- › CÁCH SO SÁNH LỰC MẠNH AXIT GIỮA CÁC AXIT VỚI NHAU
- › KHÁI NIỆM VỀ CHẤT ĐIỆN LI, SỰ ĐIỆN LI. PHÂN LOẠI CHẤT ĐIỆN LI ẠNH VÀ CHẤT ĐIỆN LI YẾU










Gửi bình luận của bạn