CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT CACBOXYLIC
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC tại Đà Nẵng giới thiệu CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT CACBOXYLIC nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 28-04-2018
20,357 lượt xem
I. ĐỊNH NGHĨA, PHÂN LOẠI VÀ CẤU TẠO
1. Định nghĩa
- Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm - COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
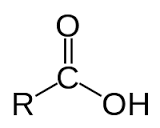
- Axit cacboxylic no, đơn chức, mạch hở: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
Ví dụ: CH3-COOH: axit axetic
II. DANH PHÁP
1. Tên thông thường của một số axit thường gặp
- Tên thông dụng của các axit cacboxylic thường được đặt theo tên của nguồn gốc tìm ra chúng như:
HCOOH Axit fomic
CH3COOH Axit axetic
CH3CH2COOH Axit propionic
CH3CH2CH2COOH Axit butiric
CH2=CH-COOH Axit acrylic
CH2=C(CH3)-COOH Axit metacrylic
(COOH)2 Axit oxalic
C6H5COOH Axit benzoic
HOOC(CH2)4COOH Axit ađipic
C15H31COOH Axit pamitic
C17H35COOH Axit stearic
C17H33COOH Axit oleic
C17H31COOH Axit linoleic
2. Tên thay thế
- Tên thay thế = Tên hiđrocacbon tương ứng + oic
III. TÍNH CHẤT VẬT LÍ
1. Nhiệt độ sôi
- Axit có nhiệt độ sôi cao hơn Ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết H và liên kết H giữa các phân tử axit bền hơn liên kết H giữa các phân tử Ancol.
2. Tính tan
- Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
IV. TÍNH CHẤT HOÁ HỌC
* Nhận xét:
- Phân tử axit có nhóm cacbonyl C = O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O - H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH RCOO- + H+
- Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
- Nếu nhóm -COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH. Gốc ankyl càng có nhiều nguyên tử H thì đẩy e càng mạnh làm cho tính axit càng giảm.
- Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH. Càng nhiều gốc hút e thì tính axit càng mạnh. Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
1. Tính axit
- Axit làm quỳ tím chuyển thành màu hồng.
- Tác dụng với bazơ → muối + H2O
Ví dụ: CH3-COOH + NaOH → CH3-COONa + H2O
- Tác dụng với oxit bazơ → muối + H2O
Ví dụ: 2CH3-COOH + CaO → (CH3-COO)2Ca + H2O
- Tác dụng với kim loại đứng trước H → muối + H2
Ví dụ: 2CH3-COOH + Mg → (CH3-COO)2Mg + H2
- Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
Ví dụ: 2CH3-COOH + Na2CO3 → 2CH3-COONa + CO2 + H2O
→ Thường dùng muối cacbonat hoặc hiđrocacbonat để nhận biết các axit cacboxylic.
2. Phản ứng este hóa (xúc tác H2SO4, t0)
Ví dụ: CH3-COOH + C2H5-OH CH3COOC2H5 + H2O
Tổng quát
R(COOH)x + R’(OH)t Ry(COO)xyR’x + xyH2O
3. Phản ứng oxi hóa hoàn toàn
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Nếu đốt cháy axit thu được nCO2 = nH2O thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH → (n + 1)CO2 + (n + 1)H2O
* Lưu ý:
- HCOOH có phản ứng tương tự như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
- Các axit không no còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dung dịch → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
Sản phẩm cộng của CH2 = CH - COOH với HX trái với Maccopnhicop
- Axit thơm có phản ứng thế vào vị trí meta.
- Axit no có phản ứng thế vào vị trí α.
V. ĐIỀU CHẾ
1. Oxi hóa anđehit (xúc tác Mn2+, t0)
CH3-CHO + 1/2O2 → CH3-COOH
Tổng quát
R(CHO)x + x/2O2 → R(COOH)x
2. Thủy phân este trong môi trường axit
CH3COOC2H5 + H2O CH3-COOH + C2H5-OH
Tổng quát
Ry(COO)xyR’x + xyH2O yR(COOH)x + xR’(OH)y
3. Thủy phân dẫn xuất 1,1,1 - trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O (H2O)
4. Riêng CH3COOH
n-C4H10 + 5/2O2 → 2CH3COOH + H2O (xúc tác Mn2+, t0)
C2H5OH + O2 → CH3COOH + H2O (men giấm)
5. Một số phản ứng khác
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH
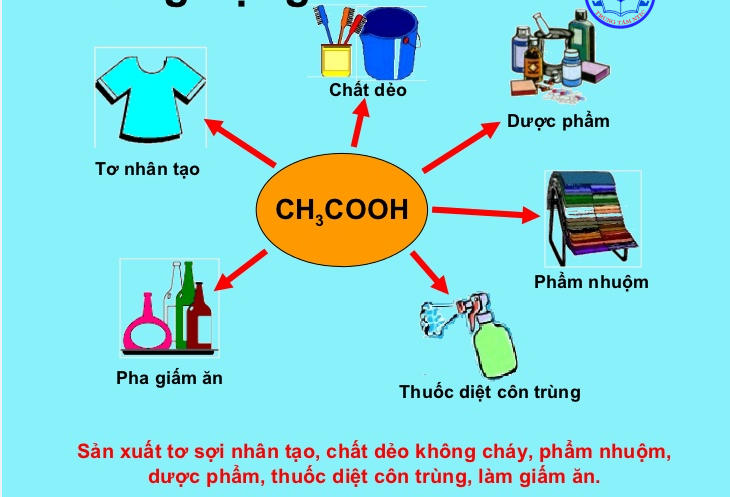
VI. ỨNG DỤNG
Trung tâm luyện thi - gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › XÁC ĐỊNH HIDROCACBON DỰA VÀO PHẢN ỨNG CHÁY
- › LÀM THẾ NÀO ĐỂ NHỚ TÊN CỦA 10 ANKAN KHÔNG PHÂN NHÁNH TRONG DÃY ĐỒNG ĐẲNG?
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA BENZEN VÀ ANKYLBENZEN
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, TÍNH CHẤT VẬT LÍ CỦA BENZEN VÀ ANKYLBENZEN
- › KHÁI NIỆM, PHÂN LOẠI CHẤT ĐIỆN LI, SỰ ĐIỆN LI
- › KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP VÀ TINH CHẤT VẬT LÍ CỦA ANDEHIT
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANDEHIT
- › SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA ANKOL VÀ PHENOL
- › KHÁI NIỆM, PHÂN LOẠI, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA PHENOL
- › SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA ANKEN VÀ ANKIN










Gửi bình luận của bạn