CẤU TẠO, TÍNH CHẤT, ỨNG DỤNG CẢU AMIN VÀ ANILIN
Trung tâm gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu KHÁI NIỆM, CẤU TẠO TÍNH CHẤT, ỨNG DỤNG CỦA AMIN VÀ ANILIN nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 15-09-2021
3,849 lượt xem
I. KHÁI NIỆM, PHÂN LOẠI, DANH PHÁP VÀ ĐỒNG PHÂN
1. Khái niệm
Ví dụ: NH3 thay 1 H bằng 1 gốc hidrocacbon CH3-: CH3-NH2: metylamin
Nếu thay 2H bằng 2 gốc hidrocacbon CH3-: CH3-NH-CH3: dimetylamin.
- Amin là hợp chất hữu cơ được tạo ra khi thế một hoặc nhiều nguyên tử hiđro trong phân tử amoniac bằng một hoặc nhiều gốc hiđrocacbon.
- Amin no, đơn chức, mạch hở CnH2n+3N (n > hoặc bằng 1)
2. Phân loại Amin được phân loại theo hai cách thông dụng nhất
a. Theo đặc điểm cấu tạo của gốc hiđrocacbon
- Gốc hirocacbon no
- Gốc hirocacbon không no
- Gốc hirocacbon thơm.
b. Theo bậc của amin
- Bậc của amin: là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hidrocacbon.
+ Amin bậc 1: R-NH2
+ Amin bậc 2: R-NH-R'
+ Amin bậc 3: R-N(R')-R''
Ngoài ra, amin còn có thể được phân loại theo (amin, béo, amin thơm và amin dị vòng).
Ví dụ:
3. Danh pháp
a. Cách gọi tên theo danh pháp gốc – chức :
ank + yl + amin
b. Cách gọi tên theo danh pháp thay thế :
ankan + vị trí + amin
c. Tên thông thường chỉ áp dụng với một số amin
Hợp chất Tên gốc – chức Tên thay thế Tên thường
CH3–NH2 metylamin metanamin
CH3–CH(NH2)–CH3 isopropylamin propan-2-amin
CH3–NH–C2H5 etylmetylamin N-metyletanamin
CH3–CH(CH3)–CH2–NH2 isobutylamin 2-metylpropan-1-amin
CH3–CH2–CH(NH2)–CH3 sec-butylamin butan-2-amin
(CH3)3C–NH2 tert-butylamin 2-metylpropan-2-amin
CH3–NH–CH2–CH2–CH3 metylpropylamin N-metylpropan-1-amin
CH3–NH–CH(CH3)2 isopropylmetylamin N-metylpropan-2-amin
C2H5–NH–C2H5 đietylamin N-etyletanamin
(CH3)2N–C2H5 etylđimetylamin N,N-đimetyletanamin
C6H5–NH2 phenylamin benzenamin anilin
* Lưu ý:
- Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c…
Ví dụ: etyl; metyl; propyl,...
- Với các amin bậc 2 và 3, chọn mạch dài nhất chứa N làm mạch chính, N có chỉ số vị trí nhỏ nhất. Đặt một nguyên tử N trước mỗi nhóm thế của amin
- Khi nhóm –NH2 đóng vai trò nhóm thế thì gọi là nhóm amino.
Ví dụ: CH3CH(NH2)COOH (axit 2-aminopropanoic)
4. Đồng phân Amin có các loại đồng phân
- Amin no, đơn chức, mạch hở CnH2n+3N (n > hoặc bằng 1).
+ Công thức tính đồng phân amin: 2n-1 (n < 5)
+ Công thức tính đồng phân amin bậc 1: 2n-2 (n < 5)
Ví dụ: C3H9N có 4 đồng phân
CH3-CH2-CH2-NH2
CH3-CH(NH2)-CH3
CH3-CH2-NH-CH3
CH3 -N(CH3)2
II. TÍNH CHẤT VẬT LÍ
- Các amin có khả năng tan tốt trong nước, do giữa amin và nước có liên kết Hiđro liên phân tử. Độ tan trong nước giảm khi số nguyên tử C tăng.
- Metyl–, đimetyl–, trimetyl– và etylaminlà những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn
- Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
III. CẤU TẠO PHÂN TỬ VÀ SO SÁNH LỰC BAZƠ
a. Cấu tạo phân tử amin
- N trong phân tử amin còn có 1 cặp electron chưa tham gia liên kết → Amin có tính bazơ.
b. So sánh lực bazơ
- Mật độ electron càng lớn thì lực bazơ càng mạnh.
(C6H5)2NH < C6H5NH2 < H-NH2 < CH3-NH2 < (CH3)2NH
c. Giải thích
- Gốc phenyl hút electron làm giảm mật độ e nên có lực bazơ yếu hơn so với amoniac thì 2 gốc phenyl sẽ khiến cho lực bazơ của amin càng yếu hơn.
- Gốc ankyl đẩy electron làm tăng mật độ e nên có lực bazơ mạnh hơn amoniac thì 2 gốc ankyl sẽ khiến lực bazơ của amin mạnh hơn nữa.
Vì vậy, anilin là một bazơ rất yếu và không làm chất chỉ thị màu thay đổi.
* Lưu ý: Amin bậc 3 do hiệu ứng không gian nên làm sai lệch độ mạnh bazơ của các amin.
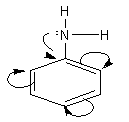
d. Cấu tạo phân tử anilin
- Do gốc phenyl (C6H5–) hút cặp electron tự do của nitơ về phía mình, sự chuyển dịch electron theo hiệu ứng liên hợp p – p (chiều như mũi tên cong) làm cho mật độ electron trên nguyên tử nitơ giảm đi, khả năng nhận proton giảm đi. Kết quả là làm cho tính bazơ của anilin rất yếu (không làm xanh được quỳ tím, không làm hồng được phenolphtalein).
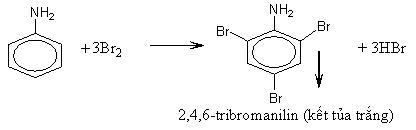
- Nhóm amino (NH2) làm tăng khả năng thế Br vào gốc phenyl (do ảnh hưởng của hiệu ứng +C). Phản ứng thế xảy ra ở các vị trí ortho và para do nhóm NH2 đẩy electron vào làm mật độ electron ở các vị trí này tăng lên.
IV. TÍNH CHẤT HÓA HỌC
1. Tính chất của chức amin
a. Tính bazơ
- Amin có tính bazơ yếu
+ Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
* Lưu ý: Anilin có lực bazơ rất yếu và không làm đổi màu quỳ tím và phenolphtalein.
+ Tác dụng với nước → dung dịch bazơ
CH3NH2 + H2O CH3NH3+ + OH-
+ Tác dụng với axit
CH3NH2 + HCl → CH3NH3Cl
C6H5NH2 + HCl → C6H5NH3Cl
+ Tác dụng với dung dịch muối của bazơ không tan tạo kết tủa.
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3CH3NH3Cl
b. Tác dụng với axit nitrơ
- Amin no bậc 1 + HNO2 → ROH + N2 + H2O.
Ví dụ: C2H5NH2 + HONO → C2H5OH + N2 + H2O
- Amin thơm bậc 1 tác dụng với HNO2 ở nhiệt độ thấp tạo thành muối điazoni.
Ví dụ: C6H5NH2 + HONO + HCl ![]() C6H5N2+ Cl- + 2H2O
C6H5N2+ Cl- + 2H2O
benzenđiazoni clorua
c. Phản ứng ankyl hóa: amin bậc 1 hoặc bậc 2 tác dụng với ankyl halogenua (CH3I, ….)
- Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
2. Phản ứng cháy
- Amin no, đơn chức, mạch hở khi bị đốt cháy thu được CO2, H2O và N2.
2CnH2n + 3N + (6n + 3)/2 O2 → 2nCO2 + (2n + 3)H2O + N2
* Nhận xét:
nH2O > nCO2
nH2O – nCO2 = 1,5x = 1,5namin
namin = 2nN2
3. Phản ứng thế ở nhân thơm của anilin
V. ỨNG DỤNG
Vì phần lớn các amin bây giờ ứng dụng nhiều làm chất chung gian điều chế các chất khác có nhiều ứng dụng quan trọng hơn nhất là các acid amin, phẩm nhuộm, các chất lưu hóa cao su...chỉ có 1 số ít là có hoạt tính sinh học.
Ví dụ
- Một số là vitamin: ví dụ thiamine chloride (1 dạng của vit B1), pyridoxine ( vit B6)
- Amphetamine: kich thich thần kinh trung ương, tăng huyết áp và mạch...nhưng gây nghiện
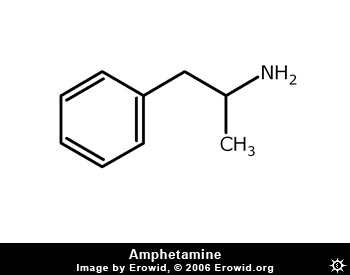
- Chloropheniramine là thành phần thuốc trị cảm cúm

- Chlorodiazeppoxide(librium) có tác dụng an thần

- Novocain và demerol-khá nổi tiếng vì liên quan đến cái chết của Michael Jackson, đc sd như thuốc gây tê và giảm đau


- Nhóm thuốc kháng khuẩn sunfa cũng là những amin đc sd nhiều trong nửa đầu TK 20: ví dụ: sulfaniamide, sulfapyridine....
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA LIPID
- › CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA ESTER
- › CACBOHIDRAT LÀ GÌ? CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA CACBOHIDRAT
- › PEPTIT LÀ GÌ? PHÂN LOẠI, TÍNH CHẤT CỦA PEPTIT VÀ PROTEIN
- › AMINO AXIT LÀ GÌ? CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA AMINO AXIT
- › PHƯƠNG PHÁP GIẢI BÀI TẬP HÓA HỮU CƠ - LỚP 12
- › PHÂN DẠNG BÀI TẬP CHẤT BÉO (TRIGLIXERIT) - HÓA 12
- › PHƯƠNG TRÌNH PHẢN ỨNG ESTE HÓA
- › ESTE LÀ GÌ? CẤU TẠO, TÍNH CHẤT VÀ ỨNG DỤNG CỦA ESTE
- › CHẤT BÉO LÀ GÌ? CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG
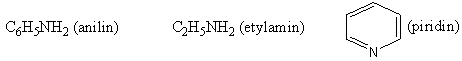










Gửi bình luận của bạn