Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng xin giới thiệu phần Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 19-09-2017
8,681 lượt xem
.jpg)
I. QUAN HỆ GIỮA VỊ TRÍ NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo của nguyên tố đó và ngược lại.
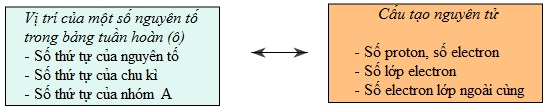
- Số thứ tự của nguyên tố (Số proton, số electron).
- Số thự tự của chu kì (Số lớp electron).
- Số thứ tự của nhóm A (Số electron lớp ngoài cùng).
Thí dụ 1: Nguyên tố có STT 17, chu kì 3, nhóm VIIA. Xác định
- Số proton, số electron trong nguyên tử?
- Số lớp electron trong nguyên tử?
- Số eletron lớp ngoài cùng trong nguyên tử?
Trả lời:
- Nguyên tử có 17p, 17e
- Nguyên tử có 3 lớp e
- Số e lớp ngoài cùng là 7
- Đó là nguyên tố Cl
Thí dụ 2: Biết cấu hình electron nguyên tử của một nguyên tố là 1s22s22p63s23p4
Trả lời:
- Tổng số electron của nguyên tử đó là 16.
- Nguyên tố đó chiếm ô thứ 16 trong bảng tuần hoàn (vì nguyên tử có 16 electron, 16 proton, số đơn vị điện tích hạt nhân là 16, bằng số thứ tự của nguyên tố trong bảng tuần hoàn).
- Nguyên tố đó thuộc chu kì 3 (vì có 3 lớp electron) thuộc nhóm VIA (vì có 6 electron lớp ngoài cùng). Đó là nguyên tố lưu huỳnh.
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Biết vị trí một nguyên tố trong bảng tuần hoàn, ta có thể suy ra những tính chất hóa học cơ bản của nó:
- Tính kim loại, tính phi kim:
+ Các nguyên tố ở các nhóm IA, IIA, IIIA (trừ H và B) có tính kim loại.
+ Các nguyên tố ở các nhóm VA, VIA, VIIA (trừ antimon, bitmut và poloni) có tính phi kim.
- Hóa trị cao nhất của nguyên tố trong hợp chất với oxi, hóa trị của nguyên tố trong hợp chất với hiđro.
- Công thức oxit cao nhất.
- Công thức hợp chất khí với hiđro (nếu có).
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
Hợpchất oxit cao nhất |
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
|
Hợp chất khí với hiđro |
|
|
|
RH4 |
RH3 |
RH2 |
RH |
- Công thức hiđroxit tương ứng (nếu có) và tính axit hay bazơ của chúng.
Thí dụ: Nguyên tố lưu huỳnh ở ô thứ 16, nhóm VIA, chu kì 3.
→ lưu huỳnh là phi kim.
- Hoá trị cao nhất với oxi là 6, công thức oxit cao nhất là SO3.
- Hoá trị với hiđro là 2, công thức hợp chất khí với hiđro là H2S.
- SO3 là oxit axít và H2SO4 là axít mạnh.
III. SO SÁNH ĐƯỢC TÍNH CHẤT CỦA NGUYÊN TỐ ĐÓ VỚI CÁC NGUYÊN TỐ XUNG QUANH
- Dựa vào qui luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
Thí dụ: So sánh: P(Z=15) với Si(Z=14) và S(Z=16)
P(Z=15) với N(Z=7) và As(Z=33)
- Si, P, S thuộc cùng một chu kì => theo chiều tăng của Z => tính PK tăng dần Si < P < S
- N, P, As thuộc cùng nhóm A => theo chiều tăng của Z => tính PK tăng dần As < P < N
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › HÓA TRỊ VÀ SỐ OXI HÓA
- › TINH THỂ NGUYÊN TỬ, TINH THỂ PHÂN TỬ
- › SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ, ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HÓA HỌC
- › SỰ TẠO THÀNH ION, LIÊN KẾT ION VÀ TINH THỂ ION
- › LUYỆN TẬP BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ, TÍNH CHẤT HÓA HỌC CỦA CÁC NGUYÊN TỐ
- › SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ
- › SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ
- › BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- › CẤU HÌNH ELECTRON NGUYÊN TỬ VÀ ĐẶC ĐIỂM ELECTRON LỚP NGOÀI CÙNG
- › CẤU TẠO CỦA VỎ ELECTRON NGUYÊN TỬ










Gửi bình luận của bạn