SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ, ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HÓA HỌC
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ, ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HÓA HỌC nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 23-09-2017
23,595 lượt xem

I. SỰ HÌNH THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
1. Khái niệm
- Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hoá trị được mã hóa bằng dấu (-)
2. Phân loại
a. Liên kết cộng hoá trị hình thành giữa các nguyên tử giống nhau → hình thành đơn chất
- Sự hình thành phân tử hiđro (H2)
H (Z =1) 1s1 → phân tử H2. Mỗi nguyên tử H có 2 electron, giống cấu hình electron bền vững của khí hiếm heli.
|
|
|
|
|
|
Giữa 2 nguyên tử hiđro có 1 cặp electron liên kết biểu thị bằng một gạch (H-H), đó là liên kết đơn.
- Sự hình thành phân tử nittơ (N2)
N (Z = 7) 1s22s22p3→ phân tử nitơ, mỗi nguyên tử nitơ phải góp chung 3 electron.

Công thức electron Công thức cấu tạo
* Nhận xét: Phân tử H2, N2 tạo nên từ 2 nguyên tử của cùng 1 nguyên tố nên cặp electron chung không bị lệch về phía nào. Đó là liên kết cộng hóa trị không phân cực.
b. Liên kết giữa các nguyên tử khác nhau → hình thành hợp chất
- Sự hình thành phân tử hiđro clorua (HCl)
![]() →
→ ![]() ; H : Cl ;
; H : Cl ; ![]() hay H - Cl
hay H - Cl
Công thức electron Công thức cấu tạo
* Nhận xét: Trong phân tử HCl cặp electron chung bị lệch về phía một nguyên tử Cl (có độ âm điện lớn hơn) gọi là liên kết cộng hoá trị có cực hay liên kết cộng hoá trị phân cực.
- Sự hình thành phân tử khí cacbon đioxit (CO2) (có cấu tạo thẳng (1)):
|
|
® |
|
|
hay O = C = O |
||
|
Công thức electron |
Công thức cấu tạo |
* Nhận xét: Liên kết giữa nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 cấu tạo thẳng nên hai liên kết đôi phân cực (C = O) triệt tiêu nhau, kết quả là phân tử này không bị phân cực.
3. Tính chất của các chất có liên kết cộng hoá trị
- Các chất mà phân tử chỉ có liên kết cộng hoá trị có thể là chất rắn như đường lưu huỳnh, iot .... Có thể là chất lỏng như: nước, ancol ... hoặc chất khí như khí cacbonic, clo, hiđro, ...
- Các chất có cực như etanol (rượu etylic), đường, ... tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như lưu huỳnh, iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua ...
* Kết luận: Các chất chỉ có liên kết cộng hoá trị không cực không dẫn điện ở mọi trạng thái.
II. ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HOÁ HỌC
1. Quan hệ giữa liên kết cộng hoá trị không cực, liên kết cộng hoá trị có cực và liên kết ion
- Nếu cặp electron chung ở giữa 2 nguyên tử, ta có liên kết cộng hoá trị không cực.
- Nếu cặp electron chung lệch về một phía của một nguyên tử thì đó là liên kết cộng hoá trị có cực.
- Nếu gặp electron chung chuyển về một nguyên tử, ta sẽ có liên kết ion.
* Kết luận: Liên kết ion có thể được coi là trường hợp riêng của liên kết cộng hoá trị.
2. Hiệu độ âm điện và liên kết hoá học
Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện.
|
Hiệu độ âm điện |
Loại liên kết |
|
từ 0,0 đến < 0,4
từ 0,4 đến < 1,7
> 1,7 |
Liên kết cộng hoá trị không cực Liên kết cộng hoá trị có cực Liên kết ion |
Thí dụ: Trong NaCl, hiệu độ âm điện của Cl và Na là: 3,16 - 0,93 = 2,23 → liên kết ion.
Trong phân tử HCl, hiệu độ âm điện của Cl và H là: 3,16 - 2,20 = 0,96 → liên kết cộng hoá trị có cực.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CLO
- › ĐỊNH NGHĨA, PHÂN LOẠI VÀ CÂN BẰNG PHẢN ỨNG OXI HÓA KHỬ
- › KIẾN THỨC CẦN NẮM VỮNG VỀ LIÊN KẾT HÓA HỌC
- › HÓA TRỊ VÀ SỐ OXI HÓA
- › TINH THỂ NGUYÊN TỬ, TINH THỂ PHÂN TỬ
- › SỰ TẠO THÀNH ION, LIÊN KẾT ION VÀ TINH THỂ ION
- › LUYỆN TẬP BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ, TÍNH CHẤT HÓA HỌC CỦA CÁC NGUYÊN TỐ
- › Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- › SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ
- › SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ
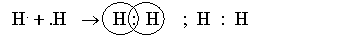










Gửi bình luận của bạn