SỰ TẠO THÀNH ION, LIÊN KẾT ION VÀ TINH THỂ ION
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu SỰ TẠO THÀNH ION, LIÊN KẾT ION VÀ TINH THỂ ION nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 23-09-2017
46,524 lượt xem

I. SỰ HÌNH THÀNH ION, CATION, ANION
1. Ion, cation, anion
a. Sự hình thành ion
- Nguyên tử trung hoà về điện. Khi nguyên tử thường hay nhận electron, nó trở thành phần tử mang điện gọi là ion.
b. Cation
- Các nguyên tử kim loại dễ nhường electron ở lớp ngoài cùng để trở thành các ion mang đơn vị điện tích dương, gọi là cation.
M → Mn+ + ne
Thí dụ 1:
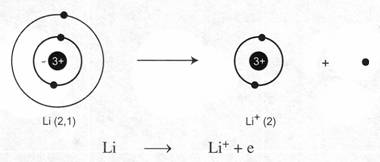
Thí dụ 2: Các nguyên tử kim loại. lớp ngoài cùng có 1, 2, 3 electron đều dễ dường electron để trở thành ion dương.
Na → Na+ + e
Mg → Mg2+ + 2e
Al → Al2+ + 3e
- Tên goi: cation + tên kim loại.
Thí dụ, Na+ gọi là cation natri.
c. Anion
- Các nguyên tử phi kim dễ nhận thêm electron để lớp ngoài cùng đạt đến cấu hình bền của khí trơ tương ứng trở thành các ion mang đơn vị điện tích âm, gọi là anion.
X + ne → Xn-
Thí dụ 1:
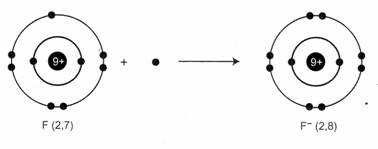
F + 1e → F-
Thí dụ 2:
Cl + 1e → Cl-
O + 2e → O2-
- Tên goi: anion + tên gốc axit (trừ O2- gọi là anion oxit).
Thí dụ: F- gọi là anion florua.
2. Ion đơn nguyên tử và ion đa nguyên tử
a. Ion đơn nguyên tử là các ion tạo nên từ một nguyên tử.
Thí dụ: cation Li+, Na+, Mg2+, Al3+ và anion F-, S2-.
b. Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm.
Thí dụ: cation amoni ![]() , anion hiđroxit OH-, anion sunfat
, anion hiđroxit OH-, anion sunfat ![]() .
.
II. SỰ TẠO THANH LIÊN KẾT ION
1. Định nghĩa
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
2. Điều kiện để hình thành liên kết ion
- Liên kết ion dược hình thành giữa kim loại điển hình và phi kim điển hình.
3. Tính chất
- không bão hòa và không định hướng.
Thí dụ: Xét sự hình thành liên kết ion trong phân tử NaCl
Nguyên tử Na (1s22s22p63s1) nhường 1 electron cho nguyên tử Cl (1s22s22p6), đồng thời nguyên tử clo nhận 1 electron của nguyên tử Na để biến đổi thành anion Cl- (1s22s22p63s23p6), có thể biểu diễn quá trình trên như sau:
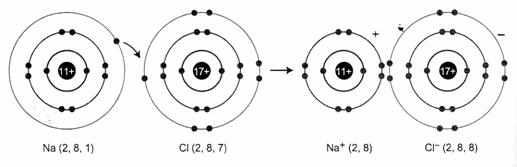
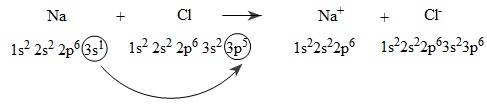
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na+ + Cl- → NaCl
Liên kết giữa cation Na+ và anion Cl- là liên kết ion.
Phản ứng hoá học trên có thể được biểu diễn bằng phương trình hoá học sau:
III. TINH THỂ ION
1. Tinh thể NaCl
Ở thể rắn, NaCl tồn tại dưới dựng tinh thể ion. Trong mạng tinh thể NaCl các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ. Xung quanh mỗi ion đều có 6 ion ngược dấu gần nhau (xem hình 3.1)
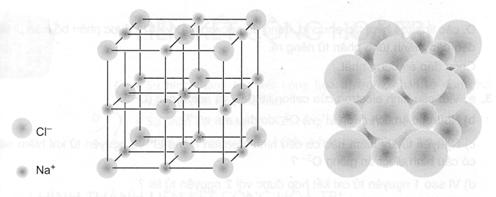
Hình 3.1. Mô hình tinh thể natri clorua NaCl
2. Tinh chất chung của hợp chất ion
- Tinh thể ion rất bền vững, khá rắn, khó nóng chảy và khó bay hơi. Vì lực hút tính điện giữa các ion ngược dấu trong tinh thể ion rất lớn.
Thí dụ: Nhiệt độ nóng chảy của NaCl là 8000C, của MgO là 28000C. - Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hoà tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › ĐỊNH NGHĨA, PHÂN LOẠI VÀ CÂN BẰNG PHẢN ỨNG OXI HÓA KHỬ
- › KIẾN THỨC CẦN NẮM VỮNG VỀ LIÊN KẾT HÓA HỌC
- › HÓA TRỊ VÀ SỐ OXI HÓA
- › TINH THỂ NGUYÊN TỬ, TINH THỂ PHÂN TỬ
- › SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ, ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HÓA HỌC
- › LUYỆN TẬP BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ, TÍNH CHẤT HÓA HỌC CỦA CÁC NGUYÊN TỐ
- › Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- › SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ
- › SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ
- › BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC










Gửi bình luận của bạn