TINH THỂ NGUYÊN TỬ, TINH THỂ PHÂN TỬ
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu TINH THỂ NGUYÊN TỬ, TINH THỂ PHÂN TỬ nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 23-09-2017
13,675 lượt xem
I. TINH THỂ NGUYÊN TỬ
1. Khái niệm về tinh thể nguyên tử
- Những nguyên tử được sắp xếp một cách đều đặn theo một trật tự nhất định trong không gian tạo thành một mạng tinh thể.
- Liên kết hóa học chủ yếu giữa những nguyên tử với nhau bằng liên kết cộng hoá trị.
2. Tính chất chung của tinh thể nguyên tử
- Nhận xét: Lực liên kết cộng hoá trị trong tinh thể nguyên tử rất lớn.
→ Tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
Ví dụ: Mạng tinh thể kim cương mỗi nguyên tử cacbon liên kết với 4 nguyên tử cacbon lân cận gần nhất bằng 4 cặp electron chung, đó là 4 liên kết cộng hoá trị. Các nguyên tử cacbon này nằm trên 4 đỉnh của một tứ diện đều (hình 3.4).
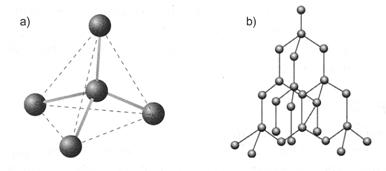
→ Kim cương có độ cứng lớn nhất so với các tinh thể đã biết nên được quy ước có độ cứng là 10 đơn vị. Đó là đơn vị để so sánh độ cứng của các chất.
II. TINH THỂ PHÂN TỬ
1. Tinh thể phân tử
- Tinh thể phân tử cấu tạo từ những phân tử được sắp xếp một cách đều đặn, theo một trật tự nhất định trong không gian tạo thành một mạng tinh thể. Ở các điểm nút của mạng tinh thể là những phân tử liên kết với nhau bằng lực tương tác yếu giữa các phân tử.
- Phần lớn các chất hữu cơ, các đơn chất phi kim ở nhiệt độ thấp đều kết tinh thành mạng lưới tinh thể phân tử (phân tử có thể gồm một nguyên tử như các khí hiếm, hoặc nhiều nguyên tử như các halogen, O2, N2, H2, H2O, H2S, CO2...).
2. Tính chất chung của tinh thể phân tử
- Nhận xét: Trong tinh thể phân tử, các phân tử vẫn tồn tại như những đơn vị độc lập và hút nhau bằng lực tương tác yếu giữa các phân tử.
→ Tinh thể phân tử dễ nóng chảy, dễ bay hơi. Ngay ở nhiệt độ thường, một phần tinh thể như naphtalen (băng phiến) và iot đã bị phá huỷ, các phân tử tách rời khỏi mạng tinh thể và khuếch tán vào không khí làm cho ta dễ nhận ra mùi của chúng.
- Các tinh thể phân tử không phân cực dễ hoà tan trong các dung môi không phân cực như benzen, toluen, cacbon tetraclorua...
Thí dụ 1: Tinh thể phân tử iot (I2) (hình 3.5). Phân tử iot là phân tử hai nguyên tử, các phân tử iot nằm trên các đỉnh và tâm các mặt của hình lập phương, gọi là tinh thể lập phương tâm diện
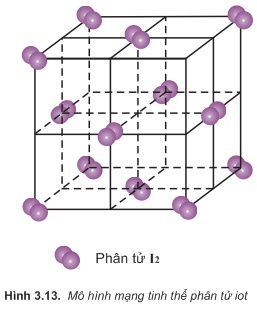
- Tính chất: Tinh thể phân tử iot không bền, iot có thể chuyển thẳng từ thể rắn sang thể hơi (sự thăng hoa).
Thí dụ 2: Mạng tinh thể nước đá thuộc loại tinh thể phân tử. Mỗi phân tử liên kết với bốn phân tử khác gần nó nhất nằm trên bốn đỉnh của một hình tứ diện đều (hình
).
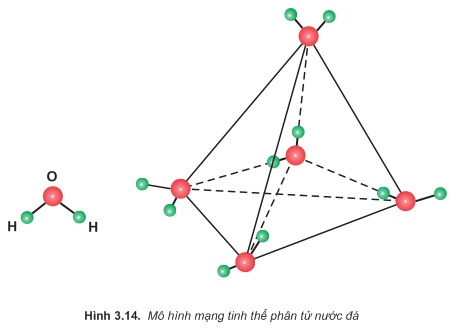
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT HCL VÀ MUỐI CLORUA
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CLO
- › ĐỊNH NGHĨA, PHÂN LOẠI VÀ CÂN BẰNG PHẢN ỨNG OXI HÓA KHỬ
- › KIẾN THỨC CẦN NẮM VỮNG VỀ LIÊN KẾT HÓA HỌC
- › HÓA TRỊ VÀ SỐ OXI HÓA
- › SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ, ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HÓA HỌC
- › SỰ TẠO THÀNH ION, LIÊN KẾT ION VÀ TINH THỂ ION
- › LUYỆN TẬP BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ, TÍNH CHẤT HÓA HỌC CỦA CÁC NGUYÊN TỐ
- › Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- › SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ










Gửi bình luận của bạn