KHÁI NIỆM VÀ TÍNH CHẤT HÓA HỌC CÁC HỢP CHẤT CHỨA OXI CỦA CLO
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần KHÁI NIỆM VÀ TÍNH CHẤT HÓA HỌC CÁC HỢP CHẤT CHỨA OXI CỦA CLO nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 14-11-2017
11,081 lượt xem
.jpg)
I. SƠ LƯỢC VỀ CÁC OXIT VÀ CÁC AXIT CÓ OXI CỦA CLO
1. Khái niệm
- Clo là chất oxi hóa mạnh nên clo có số oxi hóa là -1 trong hợp chất với kim loại và hidro. Ngoài ra, clo có số oxi hóa là +1, +3, +5, +7 trong hợp chất chứa oxi của clo.
2. Tính chất hóa học
- Hợp chất chứa oxi của clo kém bền và có tính oxi hóa rất mạnh.
3. Phân loại
a. Oxit
Cl2O3: clo (III) oxit
Cl2O5: clo (V) oxit
Cl2O7: clo (VII) oxit
* Nhận xét: Clo không trực tiếp tác dụng với Oxi nhưng Clo vẫn tạo ra các oxit được điều chế bằng con đường gián tiếp.
b. Hidroxit
: Axit hipoclorơ.
: Axit clorơ.
: Axit cloric.
: Axit pecloric.
* Nhận xét:
- Trong dãy này, axit hipoclorơ (HClO) là chất oxi hóa mạnh nhất, axit pecloric () là chất oxi hóa yếu nhất.
- Ngược lại, axit hipoclorơ (HClO) là axit yếu nhất (yếu hơn cả axit cacbonic) còn axit pecloric () là axit mạnh nhất.

c. Muối
: Natri hipoclorit.
: Natri clorit.
: Kali clorat.
: Kali peclorat.
* Nhận xét: Các muối của những axit nói trên có nhiều ứng dụng trong thực tế, trong đó thường gặp nhất là nước Gia-ven, clorua vôi và muối clorat.
II. NƯỚC GIA-VEN, CLORUA VÔI, MUỐI CLORAT
1. Nước javen
a. Điều chế
- Cho khí clo tác dụng với dung dịch NaOH loãng nguội tạo thành dung dịch hỗn hợp natri clorua và natri hipoclorit, đó là nước Gia-ven (Javel).
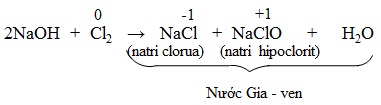
- Điện phân dung dịch natri clorua không có màng ngăn thu được nước Gia-ven
2NaCl + H2O → NaCl + NaClO + H2
b. Tính chất
- Là muối của một axit rất yếu, natri hipoclorit trong nước Gia-ven dễ tác dụng với cacbon đioxit của không khí tạo thành axit hipoclorơ.
c. Ứng dụng
Do có tính oxi hóa mạnh, axit hipoclorơ có tác dụng sát trùng , tẩy trắng sợi, vải, giấy.
Nước Gia-ven có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. Nó cũng được dùng để sát trùng và tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác.
2. Clorua vôi
a. Cấu tạo
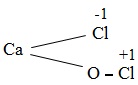
Clorua vôi là muối hỗn tạp của kim loại canxi với hai gốc axit là clorua và hipoclorit .
b. Điều chế
- Cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở , ta thu được clorua vôi:
- Clorua vôi là chất bột màu trắng, có mùi xốc của khí clo.
- Clorua vôi có tính oxi hóa mạnh. Khi tác dụng với axit clohiđric, clorua vôi giải phóng khí clo:
- Trong không khí ẩm, clorua vôi tác dụng với cacbon đioxit, làm thoát ra axit hipoclorơ:
d. Ứng dụng
* Lưu ý: So với nước Gia-ven, clorua vôi rẻ tiền hơn, có hàm lượng hipoclorit cao hơn, dễ bảo quản và dễ chuyên chở hơn.
- Clorua vôi cũng được dùng để tẩy trắng sợi, vải, giấy, để tẩy uế các hố rác, cống rãnh.
- Do có khả năng tác dụng với nhiều chất hữu cơ, clorua vôi được dùng để xử lí các chất độc.
- Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ.
3. Kali clorat
a. Điều chế
- Cho khí clo tác dụng với dung dịch kiềm nóng thì phản ứng không tạo ra muối hipoclorit mà tạo ra muối clorat
b. Tính chất vật lí
- Kali clorat là chất rắn kết tinh, không màu, nóng chảy ở .
- Kali clorat tan nhiều trong nước nóng nhưng ít tan trong nước lạnh. Vì thế, khi làm lạnh dung dịch bão hòa, dễ dàng khỏi dung dịch.
c. Tính chất hóa học
- Khi đun nóng (có MnO2 xúc tác), kali clorat rắn bị phân hủy:
và được dùng để điều chế oxi trong phòng thí nghiệm.
- Ở trạng thái rắn, kali clorat là chất oxi hóa mạnh. Photpho bốc cháy khi được trộn với kali clorat. Hỗn hợp kali clorat với lưu huỳnh và cacbon sẽ nổ khi đập mạnh.
2KClO3 + 2S + C → 2KCl + CO2 + 2SO2
d. Ứng dụng
- Kali clorat được dùng để chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ và những hỗn hợp dễ cháy khác.
- Kali clorat còn được dùng trong công nghiệp diêm. Thuốc ở đầu que diêm thường chứa gần .
- Kali clorat được dùng để điều chế oxi trong phòng thí nghiệm.
Trung tâm luyện thi - gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA SO2 (LƯU HUỲNH DIOXIT)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA H2S (HIDRO SUNFUA)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA LƯU HUỲNH (S)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OZON (O3)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXI
- › SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA CÁC HALOGEN
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC , ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA IOT
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA BROM
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA FLO
- › TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT HCL VÀ MUỐI CLORUA










Gửi bình luận của bạn