SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA CÁC HALOGEN
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu SO SÁNH CẤU TẠO VÀ TÍNH CHẤT CỦA CÁC HALOGEN nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 04-11-2017
40,910 lượt xem
I. THÀNH PHẦN, VỊ TRÍ CỦA NHÓM HALOGEN TRONG BẢNG TUẦN HOÀN
1. Thành phần
- Nhóm halogen bao gồm các nguyên tố florine (F), clorine (Cl), bromine (Br), iodine (I) và atatine (At) - là nguyên tố phóng xạ.
2. Vị trí trong Bảng tuần hoàn
- Những nguyên tố halogen thuộc nhóm VIIA.
II. CẤU TẠO NGUYÊN TỬ, CẤU TẠO PHÂN TỬ HALOGEN
1. Cấu tạo nguyên tử
- Cấu hình electron lớp ngoài cùng của X là ns2np5. Dễ dàng thực hiện quá trình :
X2 + 2e → 2X‑
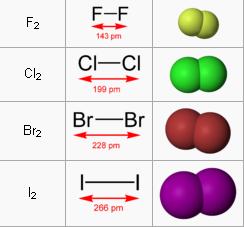
III. SỰ BIỂN ĐỔI TÍNH CHẤT CỦA HALOGEN VÀ HỢP CHẤT
1. Sự biến đổi tính chất vật lí của các đơn chất
Đi từ florine đến iodine ta thấy :
– Trạng thái tập hợp : Từ thể khí chuyển sang thể lỏng và thể rắn.
– Màu sắc : Đậm dần.
– Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần.

|
Nguyên tố Tính chất |
Florine |
Clorine |
Bromine |
lodine |
|
Số hiệu nguyên tử |
9 |
17 |
35 |
53 |
|
Bán kính nguyên tử (nm) |
0,064 |
0,099 |
0,114 |
0,133 |
|
Cấu hình electron lớp ngoài cùng của nguyên tử |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
|
Nguyên tử khối |
19 |
35,5 |
80 |
127 |
|
Trạng thái tập hợp của đơn chất ở 20°C |
khí |
khí |
lỏng |
rắn |
|
Màu sắc |
lục nhạt |
vàng lục |
nâu đỏ |
đen tím |
|
Nhiệt độ nóng chảy (tnc,°C) |
–219,6 |
–101,0 |
–7,3 |
113,6 |
|
Nhiệt độ sôi (ts,oC) |
–188,1 |
–34,1 |
59,2 |
185,5 |
|
Độ âm điện |
3,98 |
3,16 |
2,96 |
2,66 |
2. Sự biến đổi độ âm điện
– Độ âm điện tương đối lớn.
– Đi từ florine đến iodine độ âm điện giảm dần.
– Florine có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hoá –1. Các nguyên tố halogen khác, ngoài số oxi hoá –1 còn có các số oxi hoá +1, +3, +5, +7.
3. Sự biến đổi tính chất hoá học của các đơn chất
- Tính chất hóa học đặc trưng của các halogen là tính oxi hóa mạnh và giảm dần từ F2 → I2.
H2 + F2 → 2HF (phản ứng xảy ra ngay trong bóng tối, ở đk thường và gây nổ).
H2 + Cl2 → 2HCl (phản ứng xảy ra khi chiếu sáng hoặc có đun nóng và gây nổ (nếu tỉ lệ thể tích 1:1)).
H2 + Br2 → 2HBr (phản ứng xảy ra khi đun nóng)
H2 + I2 2HI (phản ứng xảy ra ở nhiệt độ cao, phản ứng xảy ra không hoàn toàn (phản ứng thuận nghịch)).
* Kết luận: Tính oxi hóa mạnh và giảm dần từ F2 → I2.
* Kết luận: Tính oxi hóa mạnh và giảm dần từ F2 → I2.
2F2 + 2H2O → 4HF + O2
d. Halogen mạnh đẩy halogen yếu ra khỏi muối
F2 + 2NaCl → 2NaF + Cl2 (Điều kiện: Florine tác dụng với NaCl khan, đun nóng).
2Cl2 + 2NaBr → 2NaCl + Br2
2Br2 + 2NaI → 2NaBr + I2
* Kết luận: Tính oxi hóa mạnh và giảm dần từ F2 → I2.
4. Sự biến đổi tính chất hóa học của hợp chất
a. Sự biến đổi tính chất của HX
- Tính khử của HX: Tăng dần từ HF < HCl < HBr < HI.
- Tính axit của dung dịch HX: Tính axit tăng dần từ HF < HCl < HBr < HI.
b. Sự biến đổi tính chất của HXO4
- Tính axit giảm dần từ HClO4 > HBrO4 > HIO4.
c. Sự biến đổi tính chất của muối halide.
Dùng AgNO3 làm thuốc thử:
NaF + AgNO3 → không tác dụng
NaCl + AgNO3 → AgCl↓ + NaNO3
màu trắng
NaBr + AgNO3 → AgBr ↓ + NaNO3
màu vàng nhạt
NaI + AgNO3 → AgI↓ + NaNO3
màu vàng
Trung tâm luyện thi - gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA H2S (HIDRO SUNFUA)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA LƯU HUỲNH (S)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OZON (O3)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXI
- › KHÁI NIỆM VÀ TÍNH CHẤT HÓA HỌC CÁC HỢP CHẤT CHỨA OXI CỦA CLO
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC , ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA IOT
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA BROM
- › CẤU TẠO, TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA FLO
- › TÍNH CHẤT VẬT LÍ, HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA AXIT HCL VÀ MUỐI CLORUA
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA CLO










Gửi bình luận của bạn