CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA H2SO4 (AXIT SUNFURIC)
Trung tâm gia sư - dạy kèm tại nhà NTIC Đà Nẵng xin giới thiệu phần CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA H2SO4 (AXIT SUNFURIC). Nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn có 1 kì thi đạt kết quả tốt.
Ngày đăng: 30-01-2018
52,107 lượt xem
I. Cấu tạo phân tử axit sunfuric
- Công thức phân tử: H2SO4
- Công thức cấu tạo:

- Mô hình phân tử H2SO4
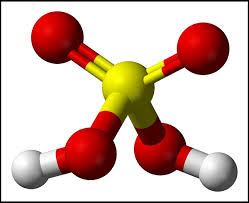
II. Tính chất vật lí
- H2SO4 là chất lỏng, nhớt, nặng hơn nước, khó bay hơi và tan vô hạn trong nước.
- H2SO4 đặc hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại vì có thể gây bỏng. H2SO4 có khả năng làm than hóa các hợp chất hữu cơ.

III. Tính chất hóa học
1. H2SO4 loãng
H2SO4 loãng là một axit mạnh, có đầy đủ các tính chất hóa học chung của axit:
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) → muối sunfat (trong đó kim loại có hóa trị thấp) + H2
Fe + H2SO4 → FeSO4 + H2
* Lưu ý:
nH2 = nH2SO4
mmuối = mkim loại + mH2SO4 - mH2 = mkim loại + 96nH2
- Tác dụng với oxit bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O
FeO + H2SO4 → FeSO4 + H2O
* Lưu ý:
nH2SO4 = nH2O = nO (trong oxit)
mmuối = moxit + mH2SO4 - mH2O = moxit + 98nH2SO4 - 18nH2O
= moxit + 80nH2SO4 = moxit + 80n(O trong oxit)
- Tác dụng với bazơ → muối + H2O
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
(phản ứng của H2SO4 với Ba(OH)2 hoặc bazơ kết tủa chỉ tạo thành muối sunfat).
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tác dụng với muối → muối mới (trong đó kim loại giữ nguyên hóa trị) + axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
* Lưu ý: Thường dùng phương pháp tăng giảm khối lượng khi giải bài tập về phản ứng của axit sunfuric với muối.
2. H2SO4 đặc
Số oxi hóa của lưu huỳnh: -2 0 +4 +6
* Nhận xét: S trong H2SO4 có mức oxi hóa +6 cao nhất.
→ H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
a. Tác dụng với kim loại
- Thí nghiệm: Cho mảnh Cu vào ống nghiệm chứa H2SO4 đặc
- Hiện tượng: dung dịch chuyển sang màu xanh và khí bay ra có mùi sốc.
- Phương trình hóa học:
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
- H2SO4 đặc, nóng tác dụng với các kim loại khác
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
5H2SO4 + 4Zn → 4ZnSO4 + H2S + 4H2O
* Lưu ý:
- Bài tập kim loại tác dụng với axit sunfuric đặc thường gặp nhất là tạo khí SO2, khi giải thường vận dụng bảo toàn e và bảo toàn nguyên tố:
ne = nkim loại.hóa trịkim loại = 2nSO2
nH2SO4 phản ứng = 2nSO2
mmuối = mkim loại + 96nSO2
- H2SO4 đặc nguội thụ động với Al, Fe và Cr.
- H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối trong đó kim loại có hóa trị cao + H2O + SO2 (S, H2S).
- Sản phẩm khử của S+6 tùy thuộc vào độ mạnh của kim loại: kim loại có tính khử càng mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp.
b. Tác dụng với phi kim → oxit phi kim + H2O + SO2
S + 2H2SO4 → 3SO2 + 2H2O (t0)
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (t0)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
c. Tác dụng với các chất khử khác
2H2SO4 + 2FeSO4 → Fe2(SO4)3 + SO2 + 2H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
d. Tính háo nước
- Thí nghiệm: Cho H2SO4 đặc vào cốc đựng đường
- Hiện tượng: Đường chuyển sang màu đen và sôi trào
- Phương trình hóa học:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
IV. Điều chế
FeS2 hoặc S → SO2 → SO3 → H2SO4
- Đốt cháy quặng firit sắt.
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
- Oxi hóa SO2 bằng oxi trong điều kiện 400 - 5000C, xúc tác V2O5)
2SO2 + O2 → 8SO3
- Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức tổng quát là H2SO4.nSO3.
nSO3 + H2SO4 → H2SO4 .nSO3
- Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
V. Ứng dụng

Axit sunfuric là hóa chất hàng đầu trong nhiều ngành sản xuất:
- Sản xuất các loại muối Sulfát
- Điều chế các axít khác yếu hơn : HNO3. HCl.
- Tẩy rửa kim loại trước khi mạ.
- Chế tạo thuốc nổ, chất dẻo, thuốc nhuộm. Dược phẩm.
- Loại axít ắc quy dùng để chế tạo ắc quy
- Xử lý nước thải.
...
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › PHÂN LOẠI PHẢN ỨNG HÓA HỌC VÔ CƠ
- › KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC VÀ CÁC YẾU TỐ ẢNH HƯỞNG
- › TỐC ĐỘ PHẢN ỨNG VÀ CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG
- › SO SÁNH TÍNH CHẤT HÓA HỌC CỦA H2SO4 LOÃNG VÀ H2SO4 ĐẶC
- › MUỐI SUNFAT, NHẬN BIẾT ION SUNFAT ỨNG DỤNG CỦA MUỐI SAUNFAT
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA SO2 (LƯU HUỲNH DIOXIT)
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA H2S (HIDRO SUNFUA)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA LƯU HUỲNH (S)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OZON (O3)
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXI










Gửi bình luận của bạn