CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA SẮT
Trung tâm gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA SẮT nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 25-12-2017
38,734 lượt xem
I. Lịch sử về nguyên tố sắt
- Trong thời kỳ từ thế kỷ 12 đến thế kỷ 10 TCN, đã có sự chuyển đổi nhanh chóng từ công cụ, vũ khí đồng thau sang sắt ở Trung Cận Đông. Yếu tố quyết định của chuyển đổi này không phải là sự xuất hiện của các công nghệ luyện sắt cao cấp hơn mà là sự cạn kiệt của các nguồn cung cấp thiếc. Thời kỳ chuyển đổi này diễn ra không đồng thời trên thế giới, là dấu hiệu cho thời kỳ văn minh mới được gọi là Thời đại đồ sắt.
II. Cấu tạo và vị trí của sắt trong bảng tuần hoàn
- Cấu hình e nguyên tử: 26Fe: 1s22s22p63s23p63d64s2.
- Vị trí: Fe thuộc ô 26, chu kì 4, nhóm VIIIB.
- Cấu hình e của các ion được tạo thành từ Fe:
Fe2+ 1s22s22p63s23p63d6
Fe3+ 1s22s22p63s23p63d5
III. Trạng thái tự nhiên và tính chất vật lí
1. Trạng thái tự nhiên
- Trong tự nhiên, người ta chỉ gặp sắt tự do trong các mảnh thiên thạch. Nhưng hợp chất của sắt tồn tại dưới dạng quặng thì rất phong phú, có rải rác nhiều nơi trên Trái Đất (sắt chiếm 5% khối lượng vỏ Trái Đất, đứng hàng thứ hai sau nhôm).
Dưới đây là một số quặng sắt quan trọng trong tự nhiên:
- Quặng hematit, có hai loại:
+ Hematit đỏ, chứa Fe2O3 khan.
+ Hematit nâu, chứa Fe2O3.nH2O
- Quặng manđehit chứa Fe3O4 là quặng giàu sắt nhất, nhưng hiếm có trong tự nhiên.
- Quặng xiđehit chứa FeCO3
- Quặng pirit chứa FeS2, có nhiều trong tự nhiên.
- Quặng sắt có giá trị sản xuất gang là manđehit và hematit.
2. Tính chất vật lí
- Màu trắng hơi xám, dẻo, dễ rèn, dễ dát mỏng, kéo sợi; dẫn nhiệt và dẫn điện kém đồng và nhôm.
- Sắt có tính nhiễm từ nhưng ở nhiệt độ cao (8000C) sắt mất từ tính. T0nc = 15400C.
IV. Tính chất hóa học
- Fe là chất khử trung bình. Trong các phản ứng, Fe có thể nhường 2 hoặc 3e:
Fe → Fe3+ + 3e
Fe → Fe2+ + 2e
1. Tác dụng với các phi kim
Sắt tác dụng với hầu hết các phi kim khi đun nóng:
- Với halogen → muối sắt (III) halogenua (trừ iot tạo muối sắt II):
2Fe + 3X2 → 2FeX3 (t0)
- Với O2:
3Fe + 2O2 → Fe3O4 (t0)
* Lưu ý: Khi giải bài tập dạng này thì sản phẩm tạo thành là hỗn hợp gồm Fe và các oxit sắt.
- Với S:
Fe + S → FeS (t0)
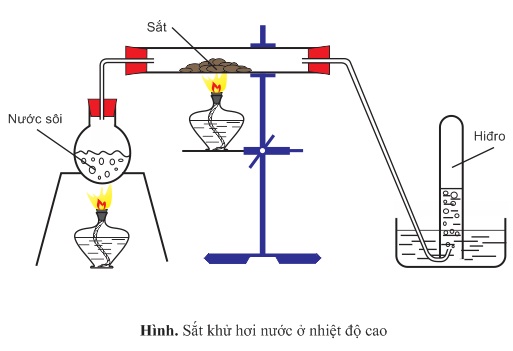
2. Tác dụng với nước
- Fe không tác dụng với nước ở nhiệt độ thường, ở nhiệt độ cao, sắt phản ứng mạnh với hơi nước:
3Fe + 4H2O → Fe3O4 + 4H2 (< 5700C)
Fe + H2O → FeO + H2 (> 5700C)
3. Tác dụng với dung dịch axit
a. Với H+ (HCl, H2SO4 loãng... ) → muối sắt (II) + H2
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 loãng → FeSO4 + H2
b. Tác dụng với các axit có tính oxi hóa mạnh (HNO3, H2SO4 đậm đặc)
- Fe thụ động với H2SO4 đặc nguội và HNO3 đặc nguội → có thể dùng thùng Fe chuyên chở axit HNO3 đặc nguội và H2SO4 đặc nguội.
- Với dung dịch HNO3 loãng → muối sắt (III) + NO + H2O:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
- Với dung dịch HNO3 đậm đặc → muối sắt (III) + NO2 + H2O:
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
- Với dung dịch H2SO4 đậm đặc và nóng → muối sắt (III) + H2O + SO2:
2Fe+ 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
* Lưu ý: Sản phẩm sinh ra trong phản ứng của Fe với HNO3 hoặc H2SO4 đậm đặc là muối sắt (III) nhưng nếu sau phản ứng có Fe dư hoặc có Cu thì tiếp tục xảy ra phản ứng:
2Fe3+ + Fe → 3Fe3+
Hoặc
2Fe3+ + Cu → 2Fe2+ + Cu2+
4. Tác dụng với dung dịch muối
- Fe đẩy được những kim loại yếu hơn ra khỏi muối → muối sắt (II) + kim loại.
Fe + CuSO4 → Cu + FeSO4
- Fe tham gia phản ứng với muối Fe3+ → muối sắt (II):
2FeCl3 + Fe → 3FeCl2
* Lưu ý: Với muối Ag+, Fe có thể tham gia phản ứng để tạo thành muối Fe3+:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag
IV. Điều chế và ứng dụng
1. Điều chế
- Sắt được điều chế theo phương pháp nhiệt luyện.
Fe2O3 + 3CO → 2Fe + 3CO2
2. Ứng dụng
- Sắt là kim loại được sử dụng nhiều nhất, chiếm khoảng 95% tổng khối lượng kim loại sản xuất trên toàn thế giới. Sự kết hợp của giá thành thấp và các đặc tính tốt về chịu lực, độ dẻo, độ cứng làm cho nó trở thành không thể thay thế được, đặc biệt trong các ứng dụng như sản xuất ô tô, thân tàu thủy lớn, các bộ khung cho các công trình xây dựng. Thép là hợp kim nổi tiếng nhất của sắt, ngoài ra còn có một số hình thức tồn tại khác của sắt như:
- Gang thô (gang lợn) chứa 4% – 5% cacbon và chứa một loạt các chất khác như lưu huỳnh, silic, phốt pho. Đặc trưng duy nhất của nó: nó là bước trung gian từ quặng sắt sang thép cũng như các loại gang đúc (gang trắng và gang xám).
- Gang đúc chứa 2% – 3.5% cacbon và một lượng nhỏ mangan. Các chất có trong gang thô có ảnh hưởng xấu đến các thuộc tính của vật liệu, như lưu huỳnh và phốt pho chẳng hạn sẽ bị khử đến mức chấp nhận được. Nó có điểm nóng chảy trong khoảng 1420–1470 K, thấp hơn so với cả hai thành phần chính của nó, làm cho nó là sản phẩm đầu tiên bị nóng chảy khi cacbon và sắt được nung nóng cùng nhau. Nó rất rắn, cứng và dễ vỡ. Làm việc với đồ vật bằng gang, thậm chí khi nóng trắng, nó có xu hướng phá vỡ hình dạng của vật.
- Thép carbon chứa từ 0,5% đến 1,5% cacbon, với một lượng nhỏ mangan, lưu huỳnh, phốt pho và silic.
- Sắt non chứa ít hơn 0,5% cacbon. Nó là sản phẩm dai, dễ uốn, không dễ nóng chảy như gang thô. Nó có rất ít cacbon. Nếu mài nó thành lưỡi sắc, nó đánh mất tính chất này rất nhanh.
- Các loại thép hợp kim chứa các lượng khác nhau của cacbon cũng như các kim loại khác, như crôm, vanađi, môlipđen, niken, vonfram, v.v.
- Ôxít sắt (III) được sử dụng để sản xuất các bộ lưu từ tính trong máy tính. Chúng thường được trộn lẫn với các hợp chất khác, và bảo tồn thuộc tính từ trong hỗn hợp này.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA MUỐI SẮT (II)
- › TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC , ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA HIDROXIT SẮT
- › TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC , ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXIT SẮT (III) (Fe2O3)
- › TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXIT SẮT TỪ (Fe3O4)
- › TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC , ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA OXIT SẮT (II)
- › NGUYÊN TẮC, NGUYÊN LIỆU VÀ PHƯƠNG PHÁP SẢN XUẤT NHÔM
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA NHÔM OXIT, NHÔM HIDROXIT VÀ MUỐI CỦA NHÔM
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA NHÔM
- › KHÁI NIỆM, PHÂN LOẠI, TÁC HẠI VÀ BIỆN PHÁP LÀM MỀM NƯỚC CỨNG
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CÁC HỢP CHẤT CỦA KIM LOẠI KIỀM THỔ










Gửi bình luận của bạn