VỊ TRÍ, CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA KIM LOẠI KIỀM
Trung tâm gia sư - dạy kèm tại nhà NTIC Đà Nẵng giới thiệu VỊ TRÍ, CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA KIM LOẠI KIỀM nhằm hỗ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Ngày đăng: 06-11-2017
25,010 lượt xem

I. VỊ TRÍ VÀ CẤU TẠO
1. Vị trí của kim loại kiềm trong bảng tuần hoàn
, đứng ở mỗi đầu chu kì (trừ chu kì 1 )
2. Cấu tạo của kim loại kiềm
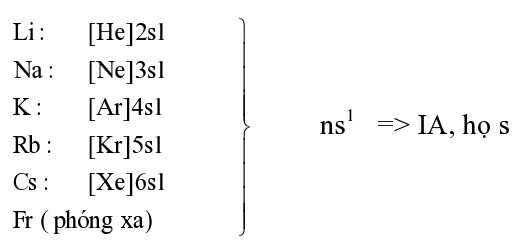
* Nhận xét:
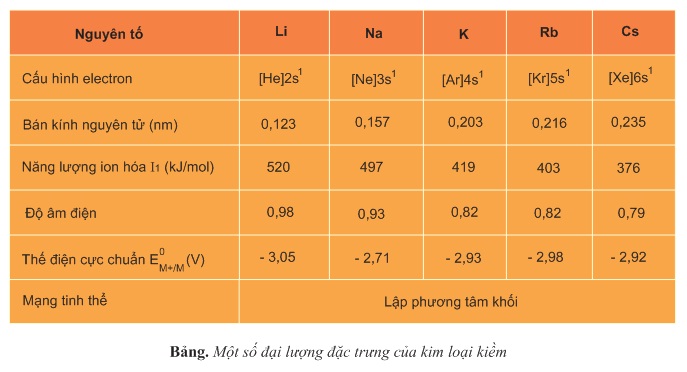
- Có 1e lớp ngoài cùng (rất ít) nhưng bán kính nguyên tử lớn (lớn nhất so với các nguyên tố trong cùng 1 chu kì) → dễ tách khỏi nguyên tử (năng lượng ion hóa nhỏ).
M → M+ + 1e
- Liên kết kim loại trong mạng tinh thể kim loại kiềm kém bền vững.
- Năng lượng ion hóa giảm dần từ Li → Cs.
- Bán kính nguyên tử tăng dần từ Li → Cs.
- Độ âm điện giảm dần từ Li → Cs.
- Thế điện cực chuẩn rất âm và tăng dần từ từ Li → Cs.
- Mạng tinh thể của kim loại kiềm lập phương tâm khối → rỗng và xốp.
→ Kim loại kiềm có tính khử rất mạnh và tăng dần từ Li → Cs.
II. TÍNH CHẤT VẬT LÍ
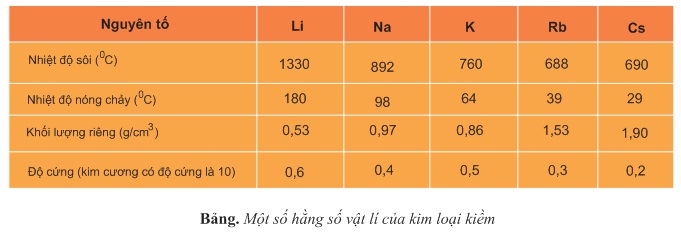
- Các kim loại kiềm có cấu tạo mạng tinh thể lập phương tâm khối là kiểu mạng kém đặc khít (rỗng và xốp).
- Liên kết kim loại trong mạng tinh thể kim loại kiềm kém bền vững.
→ Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại kiềm thấp hơn nhiều so với các kim loại khác.
→ Khối lượng riêng của các kim loại kiềm cũng nhỏ hơn so với các kim loại khác.
→ Các kim loại kiềm đều mềm, có thể cắt chúng bằng dao.
III. TÍNH CHẤT HÓA HỌC
- Kim loại kiềm có tính khử rất mạnh và tăng dần từ Li → Cs.
1. Tác dụng với phi kim
- Hầu hết các kim loại kiềm có thể khử được các phi kim.
+ Tác dụng với oxi → hỗn hợp oxit và peoxit
Ví dụ: 4Na + O2 → 2Na2O
2Na + O2 → Na2O2
+ Tác dụng với halogen → muối halogenua
Ví dụ: 2Na + Cl2 → 2NaCl
+ Tác dụng với lưu huỳnh → muối sunfua
Ví dụ: 2Na + S → 2Na2S
2. Tác dụng với axit
- Kim loại kiềm dễ dàng khử H+ của dung dịch axit của HCl, H2SO4 thành H2 (phản ứng gây nổ nguy hiểm)
Ví dụ: 2Na + 2HCl → 2NaCl + H2
3. Tác dụng với nước
- Liti: viên liti chạy trên mặt nước và bốc cháy
- Natri: khá giống với Li, đám cháy lâu hơn và gây ra vụ nổ nhỏ
- Kali: vụ nổ lớn, phản ứng vô cùng mãnh liệt
- Rb, Cs, Fr: các bạn hãy dự đoán khả năng phản ứng
Tổng quát: 2M + 2H2O → 2MOH + H2
Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa.
IV. ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
- Phương pháp thường dùng để điều chế kim loại kiềm là điện phân nóng chảy muối halogenua của kim loại kiềm.
Ví dụ: Điện phân nóng chảy muối NaCl
Catot ( – ) NaCl
Anot ( + )
2 Na+ + e → Na 2Cl- → Cl2 + 2e
Phương trình điện phân là:
2NaCl → 2Na + Cl2
2. Ứng dụng
Kim loại kiềm có nhiều ứng dụng quan trọng:
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,...
- Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài lò phản ứng hạt nhân.
- Kim loại xesi dùng chế tạo tế bào quang điện.
- Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
- Kim loại kiềm được dùng nhiều trong tổng hợp hữu cơ.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Tin liên quan
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA NHÔM OXIT, NHÔM HIDROXIT VÀ MUỐI CỦA NHÔM
- › CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA NHÔM
- › KHÁI NIỆM, PHÂN LOẠI, TÁC HẠI VÀ BIỆN PHÁP LÀM MỀM NƯỚC CỨNG
- › TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CÁC HỢP CHẤT CỦA KIM LOẠI KIỀM THỔ
- › VỊ TRÍ, CẤU TẠO, TÍNH CHẤT, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA KIM LOẠI KIỀM THỔ
- › LÍ THUYẾT VỀ PHƯƠNG PHÁP ĐIỆN PHÂN
- › NGUYÊN TẮC ĐIỀU CHẾ VÀ CÁC PHƯƠNG PHÁP ĐIỀU CHẾ KIM LOẠI
- › CẶP OXI HÓA - KHỬ, KHÁI NIỆM VỀ DÃY ĐIỆN HÓA VÀ Ý NGHĨA
- › TÍNH CHẤT HÓA HỌC CHUNG CỦA KIM LOẠI
- › CẤU TẠO VÀ TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI










Gửi bình luận của bạn